Leistungen Labor Krone
- Beratung zur Diagnostik und Therapie der Treponematosen
- Durchführung spezieller serologischer Untersuchungen zur Diagnostik der Syphilis
- Vergleichende Untersuchungen in Serum und Liquor cerebrospinalis zur Diagnostik der Neurosyphilis
- Vergleichende Untersuchungen bei Mutter und Kind zur Diagnostik der konnatalen Syphilis
- Nachweis von T.-pallidum-DNS in Abstrichmaterial, EDTA-BLUT, Fruchtwasser oder Gewebebiopsien
- Beratung zu Probenmaterial und Versandbedingungen
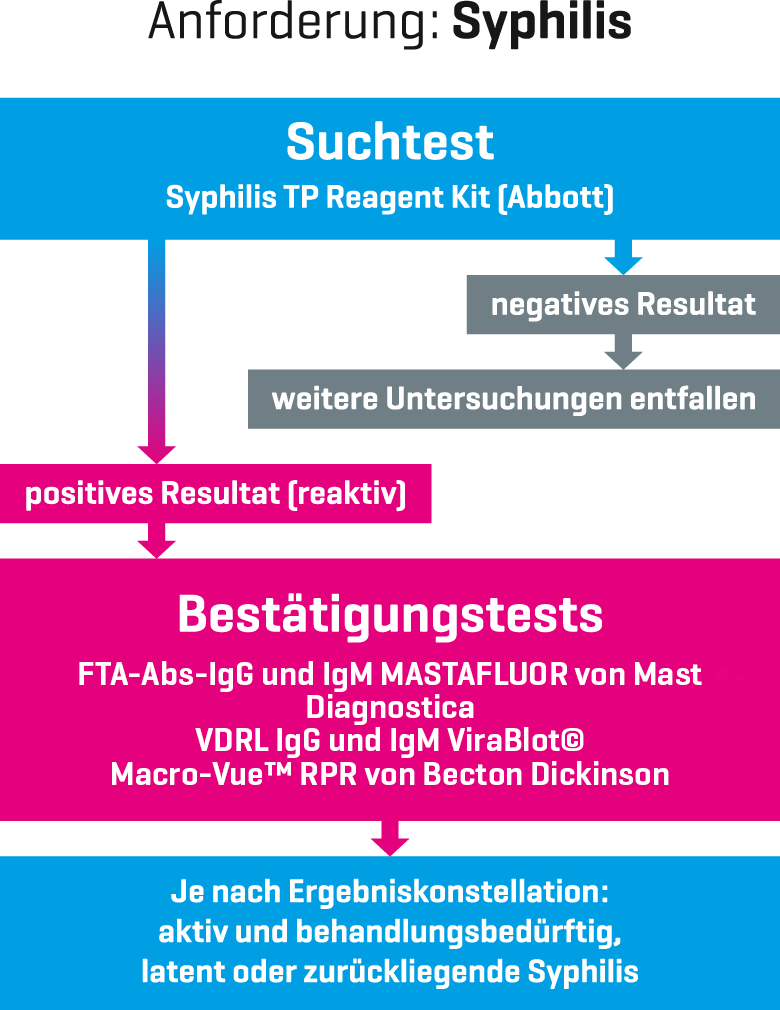
Empfohlene Stufendiagnostik (Erstuntersuchung)
Das MVZ Labor Krone arbeitet mit dem Modell der serologischen Stufendiagnostik, angelehnt an die Leitlinien der deutschen STI-Gesellschaft.
Optionale Tests
- Restbestände des TPPAs: Nur bei Verdacht auf Neurosyphilis verwenden – für Rückfragen bitte melden Sie sich bei uns
- IgG- und IgM-Immunblot im Blut
- Treponemen-PCR in Blut, Abstrich, Liquor, Punktat, Ejakulat, etc.
- Wichtigste Indikation: Untersuchung von Abstrichen von Haut- und Schleimhautläsionen im frühen Primärstadium der Syphilis als Alternative zur Dunkelfeldmikroskopie
- Wegen unzureichender Sensitivität in anderen Materialien ist insbesondere im Blut die PCR nicht geeignet als Screeningtest
- Ein negativer PCR-Befund schließt eine Treponemeninfektion nicht aus
Sensitivität und Spezifität
- Spezifität 99,94 %
- Sensitivität 100 %
- Referenzwert lt. Hersteller: <1 Index
- Hausintern wird ab einem Index ≥ 0,30 Index ein TPPA zur Kontrolle durchgeführt
FTA-Abs IgG
• Spezifität: 94,63%
• Sensitivität: 99,52%
FTA-Abs IgM
• Spezifität: 91,14%
• Sensitivität: 95,73%
Referenzwerte
• FTA-Abs-IgG: negativ
• FTA-Abs-IgM: <1:10
Viramed IgG-Immunblot
- Spezifität 92-100 %
- Sensitivität 92-100 %
Viramed IgM-Immunblot
- Spezifität 92-99 %
- Sensitivität 92-99 %
- Spezifität 100 %
- Sensitivität 100 %
- Referenzwert lt. Hersteller: negativ